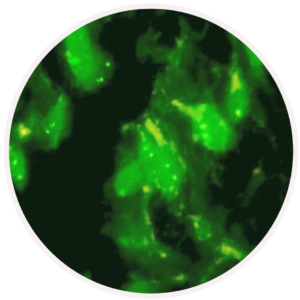
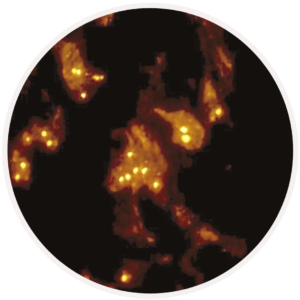
Sonda para detecção do gene HER2 em carcinoma mamário. No mesmo tecido, foi aplicada simultaneamente a sonda para a detecção do cromossomo 17, onde o gene HER2 está localizado. O resultado da reação é dado dividindo-se o número de sinais do gene HER2 pelo número de sinais do cromossomo 17.
Hibridização “in situ” é uma técnica laboratorial que utiliza uma sonda (DNA ou RNA complementar ou ainda uma sonda sintetizada em laboratório) para identificar uma sequência específica de ácido nucleico. Diferente da imunoistoquímica, que geralmente identifica a expressão proteica, a hibridização “in situ” localiza uma alteração diretamente na fita de DNA ou RNA.
É uma ferramenta indispensável à medida que os diagnósticos, sobretudo oncológicos, cada vez mais requerem marcadores moleculares para diagnóstico integrado, identificação de subgrupos moleculares e alvos terapêuticos específicos em medicina personalizada.
Caso o exame anatomopatológico tenha sido realizado em outro laboratório, o paciente ou responsável deve encaminhar o bloco parafinado com o tecido a ser estudado e entregá-lo ao Multipat (ou enviá-lo pelo correio ou outro meio de transporte).
A Hibridização “in situ” ou “ISH” (do inglês “in situ hybrization) pode ser aplicada através de diferentes métodos. Um dos métodos mais comuns utiliza um marcador fluorescente para a sonda estudada. Esta técnica, chamada de FISH (ou “fluorescence in situ “hybridization”) requer um microscópio especial, de campo escuro, para a leitura da lâmina. O FISH pode ser multiplexível, quando duas ou mais sondas com fluorocromos diferentes são aplicados ao mesmo tempo em uma amostra. Esta técnica permite avaliar presença e número de cópias de um gene, análise de mutação, rearranjo e amplificação.
| Cookie | Duração | Descrição |
|---|---|---|
| cookielawinfo-checkbox-analytics | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Analytics". |
| cookielawinfo-checkbox-functional | 11 months | The cookie is set by GDPR cookie consent to record the user consent for the cookies in the category "Functional". |
| cookielawinfo-checkbox-necessary | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookies is used to store the user consent for the cookies in the category "Necessary". |
| cookielawinfo-checkbox-others | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Other. |
| cookielawinfo-checkbox-performance | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Performance". |
| viewed_cookie_policy | 11 months | The cookie is set by the GDPR Cookie Consent plugin and is used to store whether or not user has consented to the use of cookies. It does not store any personal data. |
Responsável técnico: Dr. Leandro Luiz Lopes de Freitas – CRM/SP 96594 – RQE 62898

